Hai phân tử HCl và H2O. Dựa vào sự khác nhau về độ âm điện, phân tử nào có liên kết cộng hóa trị có cực?Viết công thức điện tử và công thức cấu tạo của phân tử… trong đề kiểm tra hóa học lớp 10 trường THCS Nguyễn Đại Thành năm 2019
đề tài
Phần 1: Trắc nghiệm (4 điểm)
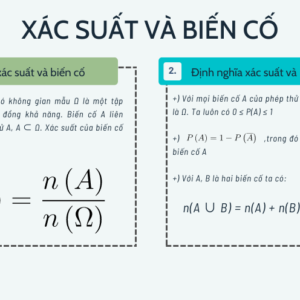
Câu hỏi 1. Đối với các ion: Na+nhôm3+Vì thế42-bé nhỏ4+KHÔNG3–clo–chuyển khoản2+. Có bao nhiêu anion?
Một. 2 b. 3 c. 4 Đ. 5
chương 2. Liên kết ion là liên kết được hình thành bởi:
Một. chia sẻ một điện tử duy nhất.
b. Cho và nhận các electron hóa trị.
c. Lực hút tĩnh điện giữa các ion mang điện trái dấu.
Đ. Lực hút tĩnh điện giữa các ion dương và các electron tự do.
Mục 3. Hóa trị điện của nguyên tố Cl trong hợp chất nguyên tố nhóm IA là
Một. 2- b. 2+ c. Đầu tiên- Đ. 1+.
Phần 4. Hợp chất có liên kết ion trong phân tử là
Một. bé nhỏ4đất sét. b. bé nhỏ3. c. axit hydrochloric. Đ. h2thâm thúy.
Câu 5. Br.Liên kết hóa học trong phân tử2 Loại liên kết
Một. liên kết cộng hóa trị không cực. b. Liên kết hóa trị cực
c. ion Đ. hydro
Mục 6. Liên kết trong phân tử của HF, HCl, HBr và HI đều là
Một. liên kết ion.
b. Liên kết hóa trị cực.
c. liên kết cộng hóa trị không cực.
Quảng cáo
Đ. liên kết đôi.
Mục 7. Giá trị độ âm điện của các nguyên tố đã cho: F(3,98);O(3,44);C(2,55);H(2,20);Natri(0,93). Hợp chất nào sau đây là hợp chất ion?
Một. natri florua. b. chỉ một4. c. h2thâm thúy. Đ. carbon monoxide2.
Mục 8. SO .Số oxi hóa của S trong phân tử2 trở nên:
Một. +2 b. +4 c. +6 Đ. – đầu tiên
Mục 9. Trong phản ứng Fe .3ôxy4 Tác dụng với HNO3 Sản xuất sản phẩm Fe(NO.)3)3không , và họ2O thì một phân tử Fe3ôxy4 sẽ
Một. Nhường 1 electron.
b. nhận 1 electron.
c. Nhường 3 electron.
Đ. Nhường 2 electron.
Mục 10. Cho phản ứng: CO + Fe2ôxy3 → Sắt + CO2.Trong phản ứng trên, CO đóng vai trò là
Một. chất oxi hóa.
b. Cả chất oxi hóa và chất khử
c. oxit trung tính.
Đ. chât khử.
Mục 11. Cho các phản ứng sau:
(1) 4HCl+ mangan đioxit2→ Mangan clorua2 + clo2 + 2 nhà2thâm thúy.
(2) 2HCl + Fe → FeCl2 + bạn bè2.
(3) 6HCl + 2Al → 2AlCl3 + 3 giờ2.
(4) 16HCl+2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8 giờ2thâm thúy.
Phản ứng trong đó HCl thể hiện tính oxi hóa là
Một. (2) và (3).
b. (1 và 2).
c. (1) và (4).
Đ. (3) và (4).
Mục 12. Viết phương trình hóa học: Zn + HNO3 → Kẽm (KHÔNG3)2 + nữ2 + bạn bè2ôxy
Hệ số cân bằng tổng (số nguyên, cực tiểu) của phản ứng là
Một. 26 b. 28 c. 27 Đ. 29
2. Nghị luận (7 điểm)
Câu 1: (2 điểm) giải thích:
| biểu tượng phần tử | Ô (Z=8) | Canxi (Z=20) | Clo (Z=17) | H (Z=1) |
| độ âm điện | 3,44 | 1,00 | 3.16 | 2,20 |
1. Viết cấu hình electron nguyên tử của oxi, canxi và clo.
2. Xét phân tử CaCl2
Tính hiệu độ âm điện giữa các nguyên tử Ca và Cl.Kể tên loại liên kết trong phân tử CaCl2
Mô tả sự hình thành liên kết trong phân tử CaCl2
3. Xét hai phân tử HCl và H2O. Dựa vào sự khác nhau về độ âm điện, phân tử nào có liên kết cộng hóa trị có cực? Viết công thức cấu tạo và điện tử của phân tử.
Câu 2 (3 điểm): Dùng phương pháp thăng bằng electron để cân bằng các phản ứng oxi hóa khử sau. Xác định chất oxi hóa, chất khử trong mỗi phản ứng.
Một. h2S + nước brom2 + bạn bè2O → làm thế nào2Vì thế4 + axit bromhydric
b. Sắt oxit + axit nitric3 → Fe(NO.)3)3 + không + thánh2ôxy
c.thuốc tím4 + sắt sunfat4 + bạn bè2Vì thế4 → Đồng koruna của Séc2Vì thế4 + mangan dioxit4 + sắt2(Vì thế)4)3 + bạn bè2ôxy
Câu 3 (1,5 điểm). Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,30% khối lượng. Để xác định hàm lượng lưu huỳnh của một loại nhiên liệu, người ta cần lấy 100,0 gam nhiên liệu đó và đốt cháy hoàn toàn. Khí tạo thành chỉ chứa cacbon đioxit, lưu huỳnh đioxit và hơi nước được dẫn vào nước thu được 500,0 ml dung dịch. Biết rằng toàn bộ lưu huỳnh đioxit đã tan hết thành dung dịch. Lấy 10,0 mL dung dịch này cho tác dụng hết với 12,5 mL dung dịch KMnO.4 Ngày 5 tháng 10 năm 2010-3 M. Sản phẩm phản ứng thu được sau phản ứng với K2Vì thế4Mangan dioxide4 với họ2Vì thế4.
a/ Viết phương trình hóa học của SO2 và dung dịch kali permanganat4.
b) Tính phần trăm (theo khối lượng) của lưu huỳnh trong nhiên liệu trên. Nhiên liệu này có được phép sử dụng không?
Câu 4 (0,5 điểm) Cho 5,68 gam hỗn hợp X gồm Fe, FeO, Fe2ôxy3 và sắt3ôxy4 Phản ứng hoàn toàn với dung dịch HNO3 Pha loãng dư thu được 0,672 L khí NO (sản phẩm khử duy nhất, ở đtc) và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Tính giá trị của m.